Žiadne produkty
Ceny sú s DPH
Kategórie
- Ponuka práce: FARMACEUT - LEKÁRNIK
- K O R O N A V Í R U S - COVID-19
- Plus lekáreň
- Ambulancia lekára
- Bandáže, návleky, pásy
- Barle, palice, chodítka
- Bylinné prípravky
- Dezinfekcia
- Diagnostické testy
- Elektro
- Glukometer
- Iné pomôcky pre pacientov
- Inhalátory
- Inkontinencia - únik moču
- Invalidita
- Kompresívna liečba
-
Kozmetika - Drogéria
- Telová kozmetika
- Vlasová kozmetika
- Pleťová kozmetika
- Prípravky na holenie a depiláciu
- Intímna hygiena
- Pranie
- Domácnosť
-
Značky
- Himalaya
- Adidas
- Airwick
- Ajax
- Alex
- Always
- Ambipur
- Ariel
- Aussie
- Axe
- Batiste
- Bel
- Bonux
- Bref
- Bubchen
- Calgon
- Cif
- Cilit Bang
- Clin
- Coccolino
- Denim
- Dettol
- Discreet
- Domestos
- Dove
- Duck
- Durex
- Elseve
- Eos
- Fa
- Finish
- Fixinela
- Garnier
- Gillette
- Glade
- Got2be
- Head & Shoulders
- Jar
- Johnsons
- Kallos
- Kleenex
- Kneipp
- Ko+ex
- Lanza
- Lenor
- Loreal
- Mexx
- Mr. Proper
- Naturella
- Neutrogena
- Nivea
- Nova Car Care
- o.b.
- Old Spice
- Oral -B
- Palette
- Palmolive
- Pampers
- Pantene
- Persil
- Perwoll
- Playboy
- Pronto
- Puella
- Pur
- Raid
- Rex
- Rexona
- Ria
- Sanytol
- Savo
- Schauma
- Scholl
- Signal
- Silan
- Somat
- STR8
- Syoss
- Taft
- Tesori d-oriente
- TRESemmé
- Vanish
- Veet
- Wella
- Wilkinson
- Woolite
- Zewa
- Starostlivosť o vlasy
- Lekárničky, náplne
- Liečba svetlom
- Masážne prípravky
- Mikroskopy
- Opaľovanie
- Optické prístroje špeciálne
- Pečené čaje z ovocia
- Potravinové doplnky
- Pre dámy
- Pre deti
- Pre pánov
- Preležaniny a ošetrovanie
- Repelenty
- Starostlivosť o nechty
- Starostlivosť o nohy
- STÓMIA a stomické pomôcky
- Teplomery
- Tlakomery
- Veterinárne liečivá
-
Voľnopredajné lieky
- Alergia
- Antikoncepcia
- Bolesť hlavy
- Bolesť hrdla
- Bolesť svalov a kĺbov
- Bolesti zubov
- Chrípka a prechladnutie
- Dezinfekcia kože
- Fytofarmaká
- Homeopatiká
- Horúčka
- Horúčka u detí
- Imunitný systém
- Intímna hygiena
- Kašeľ
- Kožné choroby
- Kŕčové žily
- Krv, srdce a obehový systém
- Menštruačné bolesti
- Na chudnutie
- Poruchy trávenia
- Spánok
- Stop fajčeniu
- Upchatý nos
- Vlasy, nechty pokožka
- Výživové doplnky
- Urologické problémy
- Zmyslové orgány
- Pamäť a normálná funkciá nervovej sústavy
-
Voľnopredajné lieky podľa skupín
- 69 - Otorinolaringologiká
- 24 - Antihistaminiká, histamín
- 46 - Dermatologiká
- 17 - Antikoncepčné prípravky
- 07 - Analgetiká, antipyretiká
- 29 - Antireumatiká, antiflogistiká, antiuratiká
- 86 - Vitamíny, vitagény
- 52 - Expektoranciá, mukolytiká
- 93 - Homeopatiká
- 94 - Fytofarmaká
- 15 - Antibiotiká (proti mikróbom a vírusovým infekciám)
- 39 - Soli a ióny pre perorálnu a perenterálnu aplikáciu
- 70 - Anxiolytiká
- 85 - Venofarmaká, vazoprotektíva
- 87 - Varia I
- 95 - Stomatologiká III
- 49 - Digestíva, adsorbenciá, acidá
- 32 - Antiseptiká, dezinficienciá (lokálne)
- 92 - Tradičný rastlinný liek
- 91 - Multivitamíny a stopové prvky
- 54 - Gynekologiká
- 36 - Antitusiká
- 26 - Antimykotiká (lokálne a celkové)
- 42 - Chemoterapeutiká (vrátane tuberkulostatík)
- 23 - Antihemoroidiká
- 16 - Antikoagulanciá (fibrinolytiká, antifibrinolytiká)
- 41 - Kardiaká
- 12 - Antianemiká
- 61 - Laxatíva
- 43 - Choleretiká, cholekinetiká
- 09 - Antacidá (vrátane antiulceróznych liečiv)
- 20 - Antiemetiká, antikinetiká
- 73 - Spazmolytiká
- Výživové nápoje
- Zdravé zuby
- Všeobecná ambulancia pre dospelých, körzeti orvosi rendelö MUDr. Rudolf Pelikán
- Zdravotná obuv ktorá pomáha
- Gynekologicko - pôrodnícka ambulancia
- NANO produkty
- Naši partneri
- Záhrada
- Lekáreň TABLETKA - výučbová lekáreň
- Akreditovaný rozbor vody - Danum,s.r.o
- BEZ KONZERVANTOV DOMÁCE PRODUKTY
- Novinky
- Akcie a zľavy
Navštívené produkty
-

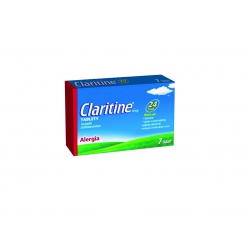
CLARITINE 10 mg tbl...
ZABUDNITE NA ALERGIU a užite si deň....

CLARITINE 10 mg tbl 10x10 mg
17890
ZABUDNITE NA ALERGIU a užite si deň. Úľava od kýchania, výtoku z nosa, slzenia očí. Účinkuje 24 hodín, môže sa užívať bez ohľadu na jedlo. * IMS sell-out databáza, kategória 01E1, hodnotové predaje, 1-12 2015. Claritine 10mg balenie 7 tabl. a 10 tabl. je voľnopredajný liek s liečivom loratadín na vnútorné použitie. LIEK NA VONKAJŠIE POUŽITIE.
- Napíšte názor
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
1. NÁZOV LIEKU
Claritine 10 mg
tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá tableta obsahuje 10 mg loratadínu.
Každá 10 mg tableta obsahuje 71,3 mg monohydrátu laktózy.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tablety
Biele alebo takmer biele oválne tablety, na jednej strane s poliacou ryhou a s označením „10“.
Deliaca ryha iba pomáha rozlomiť tabletu na ľahšie prehĺtanie a neslúži na rozdelenie na rovnaké dávky.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Claritine je indikovaný na symptomatickú liečbu alergickej nádchy a chronickej idiopatickej urtikárie.
4.2 Dávkovanie a spôsob podávania
Dospelí a deti od 12 rokov:
10 mg raz denne (jedna tableta jedenkrát denne). Tablety sa môžu užívať bez ohľadu na jedlo.
Deti od 2 do 12 rokov dostávajú dávku podľa telesnej hmotnosti:
- s telesnou hmotnosťou viac ako 30 kg: 10 mg raz denne (jedna tableta jedenkrát denne);
- s telesnou hmotnosťou 30 kg alebo menej: tablety so silou 10 mg nie sú vhodné pre deti s telesnou hmotnosťou menej ako 30 kg.
Účinnosť a bezpečnosť Claritine u detí mladších ako 2 roky nebola stanovená.
Pacientom so závažným poškodením pečene sa má podať nižšia úvodná dávka, pretože môžu mať znížený klírens loratadínu. U dospelých a detí s telesnou hmotnosťou nad 30 kg sa odporúča úvodná dávka 10 mg každý druhý deň.
U starších pacientov alebo u pacientov s renálnou insuficienciou úprava dávky nie je potrebná.
4.3 Kontraindikácie
Claritine je kontraindikovaný u pacientov s precitlivenosťou na liečivo alebo na ktorúkoľvek z pomocných látok tohto lieku.
4.4 Osobitné upozornenia a opatrenia pri používaní
Claritine sa má podávať opatrne pacientom so závažným poškodením pečene (pozri časť 4.2).
Tento liek obsahuje laktózu, preto pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
Podávanie Claritine sa má prerušiť najmenej 48 hodín pred kožnými testami, nakoľko antihistaminiká môžu brániť reakciám alebo znižovať inak pozitívne reakcie na index kožnej reaktivity.
4.5 Liekové a iné interakcie
Ako sa zistilo v štúdiách psychomotorickej výkonnosti, Claritine nezosilňuje účinky súčasne požitého alkoholu.
Možné interakcie sa môžu objaviť v súvislosti so všetkými známymi inhibítormi CYP3A4 alebo CYP2D6 a viesť k zvýšeniu hladín loratadínu (pozri časť 5.2), čo môže spôsobiť zvýšený výskyt nežiaducich účinkov.
4.6 Gravidita a laktácia
V štúdiách na zvieratách loratadín nemal teratogénne účinky. Bezpečné používanie loratadínu počas gravidity sa nestanovilo. Užívanie Claritine počas gravidity sa preto neodporúča.
Loratadín sa vylučuje do materského mlieka, preto sa jeho používanie u dojčiacich žien neodporúča.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
V klinických štúdiách, ktoré vyhodnocovali schopnosť viesť vozidlá, nedošlo u pacientov užívajúcich loratadín k žiadnemu narušeniu. Pacientov však treba informovať, že veľmi zriedkavo sa u niektorých ľudí vyvinula ospalosť, ktorá mohla ovplyvniť ich schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
V klinických štúdiách na pediatrickej populácii u detí vo veku od 2 do 12 rokov boli časté nežiaduce reakcie, hlásené navyše oproti placebu, bolesti hlavy (2,7 %), nervozita (2,3 %) a únava (1 %).
V klinických štúdiách zahŕňajúcich dospelých a dospievajúcich v rozsahu indikácií zahŕňajúcich alergickú nádchu (AR) a chronickú idiopatickú urtikáriu (CIU) boli, pri používaní odporúčanej dávky 10 mg denne, nežiaduce reakcie spojené s loratadínom hlásené u 2 % pacientov navyše oproti tým, ktorí boli liečení placebom. Najčastejšie nežiaduce reakcie, hlásené navyše oproti placebu, boli somnolencia (1,2 %), bolesť hlavy (0,6 %), zvýšenie chuti do jedla (0,5 %) a nespavosť (0,1 %). Ostatné nežiaduce reakcie, ktoré boli hlásené veľmi zriedkavo po uvedení lieku na trh, sú uvedené v nasledujúcej tabuľke.
Poruchy imunitného systému Anafylaxia
Poruchy nervového systému Závrat
Poruchy srdca a srdcovej činnosti Tachykardia, palpitácie
Poruchy gastrointestinálneho traktu Nauzea, sucho v ústach, gastritída
Poruchy pečene a žlčových ciest Abnormálna funkcia pečene
Poruchy kože a podkožného tkaniva Kožná vyrážka, alopécia
Celkové poruchy a reakcie v mieste podania Únava
4.9 Predávkovanie
Predávkovanie loratadínom zvyšovalo výskyt anticholinergných príznakov. Pri predávkovaniach boli hlásené somnolencia, tachykardia a bolesť hlavy.
V prípade predávkovania sa má začať so všeobecnými symptomatickými a podpornými opatreniami a má sa v nich pokračovať tak dlho, kým je to potrebné. Možno skúsiť podať aktívne uhlie vo forme kaše s vodou a možno zvážiť výplach žalúdka. Loratadín nemožno odstrániť hemodialýzou a účinnosť peritoneálnej dialýzy pri odstraňovaní loratadínu nie je známa. Po akútnej liečbe treba v lekárskom monitorovaní pacienta pokračovať.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antihistaminiká – antagonista H1.
ATC kód: R06AX13
Loratadín, liečivo v Claritine, je tricyklické antihistaminikum so selektívnym periférnym účinkom na H1–receptory.
U väčšiny populácie loratadín nemá, keď sa používa v odporúčanom dávkovaní, klinicky významné sedatívne ani anticholinergné vlastnosti.
Počas dlhodobej liečby sa nepozorovali žiadne klinicky významné zmeny vitálnych príznakov, hodnôt laboratórnych testov, fyzikálnych vyšetrení alebo elektrokardiogramov.
Loratadín nemá významný účinok na H2–receptory. Neinhibuje vychytávanie noradrenalínu (norepinefrínu) a prakticky nemá účinok na kardiovaskulárnu funkciu ani na vlastnú aktivitu srdcového pacemakera.
5.2 Farmakokinetické vlastnosti
Po perorálnom podaní sa loratadín rýchlo a dobre vstrebáva a podlieha extenzívnemu metabolizmu počas prvého prechodu pečeňou, predovšetkým prostredníctvom CYP3A4 a CYP2D6. Väčšina metabolitov desloratadínu (DL) je farmakologicky účinná a zodpovedá za väčšiu časť klinických účinkov. Maximálna plazmatická koncentrácia (Tmax) loratadínu sa dosiahne medzi 1 - 1,5 hodinou po podaní a maximálna plazmatická koncentrácia (Tmax) DL sa dosiahne medzi 1,5 - 3,7 hodinami po podaní.
V kontrolovaných skúšaniach bol hlásený vzostup plazmatických koncentrácií loratadínu po súčasnom použití s ketokonazolom, erytromycínom a cimetidínom. Tento však nebol sprevádzaný klinicky významnými zmenami (vrátane elektrokardiografických).
Loratadín sa silno viaže na plazmatické bielkoviny (97 % až 99 %) a jeho aktívny metabolit sa viaže stredne silno (73 % až 76 %).
Polčas distribúcie loratadínu v plazme u zdravých jedincov bol približne 1 hodina, polčas distribúcie jeho aktívneho metabolitu bol asi 2 hodiny. Priemerný polčas eliminácie u zdravých jedincov bol 8,4 hodiny (rozsah = 3 až 20 hodín) pre loratadín a 28 hodín (rozsah = 8,8 až 92 hodín) pre jeho hlavný aktívny metabolit.
Približne 40 % dávky sa vylúči do moču a 42 % do stolice v priebehu 10 dní, a to prevažne vo forme konjugovaných metabolitov. Približne 27 % podanej dávky sa vylúči do moču počas prvých 24 hodín. Menej ako 1 % liečiva sa vylúči nezmenené v účinnej forme, ako loratadín alebo DL.
Parametre biologickej dostupnosti loratadínu a jeho aktívneho metabolitu sú úmerné dávke.
Farmakokinetický profil loratadínu a jeho metabolitov je porovnateľný u zdravých dospelých dobrovoľníkov a u zdravých dobrovoľníkov vyššieho veku.
Súčasný príjem potravy môže mierne spomaliť vstrebávanie loratadínu, ale neovplyvní klinický účinok.
U pacientov s chronickým poškodením obličiek sa AUC aj maximálne plazmatické koncentrácie (Cmax) loratadínu a jeho metabolitu, oproti AUC a maximálnym plazmatickým koncentráciám (Cmax) u pacientov s normálnou funkciou obličiek, zvýšili. V porovnaní s normálnymi jedincami sa priemerné polčasy eliminácie loratadínu a jeho metabolitu významne nelíšili. U jedincov s chronickým poškodením obličiek nemá hemodialýza vplyv na farmakokinetiku loratadínu ani jeho aktívneho metabolitu.
U pacientov s chronickým alkoholovým postihnutím pečene boli AUC a maximálne plazmatické koncentrácie (Cmax) loratadínu dvojnásobné, kým farmakokinetický profil aktívneho metabolitu nebol významne odlišný od farmakokinetického profilu pacientov s normálnou funkciou pečene. Polčas eliminácie loratadínu bol 24 hodín, jeho aktívneho metabolitu 37 hodín a stúpal so vzrastajúcou závažnosťou ochorenia pečene.
Loratadín a jeho aktívny metabolit sa vylučujú do materského mlieka dojčiacich žien.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe obvyklých štúdií bezpečnosti, farmakológie, toxicity po opakovanom podaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
V štúdiách reprodukčnej toxicity sa nepozorovali teratogénne účinky. U potkanov sa však pri plazmatických hladinách (AUC) 10-krát vyšších, ako sú hladiny, ktoré sa dosiahnu po klinických dávkach, pozorovalo predĺženie pôrodu a znížená životaschopnosť potomstva.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Monohydrát laktózy, magnéziumstearát, kukuričný škrob.
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
4 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 °C.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
ALU/PVC blister, písomná informácia pre používateľov, škatuľka.
Veľkosť balenia: 7, 10, 30 alebo 60 tabliet.
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Merck Sharp & Dohme B.V.,
Waarderweg 39, 2031 BN Haarlem,
P.O. Box 581, 2003 PC Haarlem,
Holandsko
8. REGISTRAČNÉ ČÍSLO
24/0001/92-S
9. DÁTUM PRVEJ REGISTRÁCIE/ DÁTUM PREDĹŽENIA REGISTRÁCIE
30.09.2002 / bez časového obmedzenia
10. DÁTUM REVÍZIE TEXTU
Jún 2012