Žiadne produkty
Ceny sú s DPH
Kategórie
- Ponuka práce: FARMACEUT - LEKÁRNIK
- K O R O N A V Í R U S - COVID-19
- Plus lekáreň
- Ambulancia lekára
- Bandáže, návleky, pásy
- Barle, palice, chodítka
- Bylinné prípravky
- Dezinfekcia
- Diagnostické testy
- Elektro
- Glukometer
- Iné pomôcky pre pacientov
- Inhalátory
- Inkontinencia - únik moču
- Invalidita
- Kompresívna liečba
-
Kozmetika - Drogéria
- Telová kozmetika
- Vlasová kozmetika
- Pleťová kozmetika
- Prípravky na holenie a depiláciu
- Intímna hygiena
- Pranie
- Domácnosť
-
Značky
- Himalaya
- Adidas
- Airwick
- Ajax
- Alex
- Always
- Ambipur
- Ariel
- Aussie
- Axe
- Batiste
- Bel
- Bonux
- Bref
- Bubchen
- Calgon
- Cif
- Cilit Bang
- Clin
- Coccolino
- Denim
- Dettol
- Discreet
- Domestos
- Dove
- Duck
- Durex
- Elseve
- Eos
- Fa
- Finish
- Fixinela
- Garnier
- Gillette
- Glade
- Got2be
- Head & Shoulders
- Jar
- Johnsons
- Kallos
- Kleenex
- Kneipp
- Ko+ex
- Lanza
- Lenor
- Loreal
- Mexx
- Mr. Proper
- Naturella
- Neutrogena
- Nivea
- Nova Car Care
- o.b.
- Old Spice
- Oral -B
- Palette
- Palmolive
- Pampers
- Pantene
- Persil
- Perwoll
- Playboy
- Pronto
- Puella
- Pur
- Raid
- Rex
- Rexona
- Ria
- Sanytol
- Savo
- Schauma
- Scholl
- Signal
- Silan
- Somat
- STR8
- Syoss
- Taft
- Tesori d-oriente
- TRESemmé
- Vanish
- Veet
- Wella
- Wilkinson
- Woolite
- Zewa
- Starostlivosť o vlasy
- Lekárničky, náplne
- Liečba svetlom
- Masážne prípravky
- Mikroskopy
- Opaľovanie
- Optické prístroje špeciálne
- Pečené čaje z ovocia
- Potravinové doplnky
- Pre dámy
- Pre deti
- Pre pánov
- Preležaniny a ošetrovanie
- Repelenty
- Starostlivosť o nechty
- Starostlivosť o nohy
- STÓMIA a stomické pomôcky
- Teplomery
- Tlakomery
- Veterinárne liečivá
-
Voľnopredajné lieky
- Alergia
- Antikoncepcia
- Bolesť hlavy
- Bolesť hrdla
- Bolesť svalov a kĺbov
- Bolesti zubov
- Chrípka a prechladnutie
- Dezinfekcia kože
- Fytofarmaká
- Homeopatiká
- Horúčka
- Horúčka u detí
- Imunitný systém
- Intímna hygiena
- Kašeľ
- Kožné choroby
- Kŕčové žily
- Krv, srdce a obehový systém
- Menštruačné bolesti
- Na chudnutie
- Poruchy trávenia
- Spánok
- Stop fajčeniu
- Upchatý nos
- Vlasy, nechty pokožka
- Výživové doplnky
- Urologické problémy
- Zmyslové orgány
- Pamäť a normálná funkciá nervovej sústavy
-
Voľnopredajné lieky podľa skupín
- 69 - Otorinolaringologiká
- 24 - Antihistaminiká, histamín
- 46 - Dermatologiká
- 17 - Antikoncepčné prípravky
- 07 - Analgetiká, antipyretiká
- 29 - Antireumatiká, antiflogistiká, antiuratiká
- 86 - Vitamíny, vitagény
- 52 - Expektoranciá, mukolytiká
- 93 - Homeopatiká
- 94 - Fytofarmaká
- 15 - Antibiotiká (proti mikróbom a vírusovým infekciám)
- 39 - Soli a ióny pre perorálnu a perenterálnu aplikáciu
- 70 - Anxiolytiká
- 85 - Venofarmaká, vazoprotektíva
- 87 - Varia I
- 95 - Stomatologiká III
- 49 - Digestíva, adsorbenciá, acidá
- 32 - Antiseptiká, dezinficienciá (lokálne)
- 92 - Tradičný rastlinný liek
- 91 - Multivitamíny a stopové prvky
- 54 - Gynekologiká
- 36 - Antitusiká
- 26 - Antimykotiká (lokálne a celkové)
- 42 - Chemoterapeutiká (vrátane tuberkulostatík)
- 23 - Antihemoroidiká
- 16 - Antikoagulanciá (fibrinolytiká, antifibrinolytiká)
- 41 - Kardiaká
- 12 - Antianemiká
- 61 - Laxatíva
- 43 - Choleretiká, cholekinetiká
- 09 - Antacidá (vrátane antiulceróznych liečiv)
- 20 - Antiemetiká, antikinetiká
- 73 - Spazmolytiká
- Výživové nápoje
- Zdravé zuby
- Všeobecná ambulancia pre dospelých, körzeti orvosi rendelö MUDr. Rudolf Pelikán
- Zdravotná obuv ktorá pomáha
- Gynekologicko - pôrodnícka ambulancia
- NANO produkty
- Naši partneri
- Záhrada
- Lekáreň TABLETKA - výučbová lekáreň
- Akreditovaný rozbor vody - Danum,s.r.o
- BEZ KONZERVANTOV DOMÁCE PRODUKTY
- Novinky
- Akcie a zľavy
Navštívené produkty
-
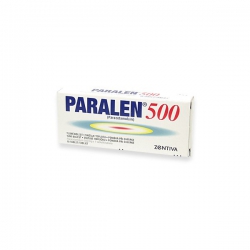
PARALEN 500 SUP sup...
Pri bolestiach rôzneho pôvodu, napr....
PARALEN 500 SUP sup 5x500 mg
26419
Pri bolestiach rôzneho pôvodu, napr. pri bolestiach hlavy, zubov, pohybového ústrojenstva, pri chrípkových ochoreniach, na zníženie zvýšenej telesnej teploty, pri bolestivej menštruácii.
- Napíšte názor
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
1. NÁZOV LIEKU
PARALEN500 SUP
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE LIEKU
Paracetamolum 500 mg v 1 čapíku
3. LIEKOVÁ FORMA
Čapík
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Horúčka, najmä pri akútnych bakteriálnych a vírusových infekciách, bolesti zubov, hlavy, neuralgie, bolesti svalov alebo kĺbov nezápalovej etiológie, bolesti vertebrogénneho pôvodu, bolestivá menštruácia.
4.2 Dávkovanie a spôsob podávania
Je individuálne.
Dospelým a mladistvým sa podáva 0,5 – 1 g paracetamolu podľa potreby v časovom odstupe najmenej 4 hodín do maximálnej dennej dávky 4 g, najvyššia jednotlivá dávka je 1 g. Pri dlhodobej terapii (vyše 10 dní) nemá denná dávka prekročiť 2,5 g.
Deťom vo veku od 9 do 12 rokov sa podáva 1 čapík 2-krát denne, deťom vo veku od 12 do 15 rokov 1 čapík 3-krát denne. Jednotlivé dávky sa podávajú v časovom odstupe najmenej 6 hodín.
Pri renálnej insuficiencii je nutné dávkovanie upravovať: pri glomerulárnej filtrácii 50 –10 ml/min sa môže podať 500 mg každých 6 hodín, pri glomerulárnej filtrácii pod 10 ml/min každých 8 hodín.
4.3 Kontraindikácie
Známa precitlivenosť na liečivo alebo ktorúkoľvek z pomocných látok, deficit glukózo-6-fosfátdehydrogenázy, hemolytická anémia, ťažké formy renálnej alebo hepatálnej insuficiencie, akútna hepatitída, súbežné podanie liekov atakujúcich pečeň, alkoholizmus.
Liek nie je určený deťom mladším ako 9 rokov alebo s telesnou hmotnosťou menšou ako 40 kg.
4.4 Osobitné upozornenia a opatrenia pri používaní
Počas liečby sa nesmú piť alkoholické nápoje.
U pacientov so zmenami pečeňových funkcií a u pacientov dlhodobo (viac ako 10 dní) užívajúcich vyššie dávky paracetamolu sa odporúča pravidelne vykonávať pečeňové testy.
Počas terapie perorálnymi antikoagulanciami a pri súčasnom dlhodobom podávaní vyšších dávok paracetamolu, najmä v kombinácii s dextropropoxyfénom či kodeínom, je nutná kontrola protrombínového času.
4.5 Liekové a iné interakcie
Hepatotoxické látky môžu zvyšovať možnosť kumulácie a predávkovania paracetamolu. Paracetamol zvyšuje hladinu kyseliny acetylsalicylovej a chloramfenikolu v plazme. Induktory mikrozomálnych enzýmov (predovšetkým rifampicín a fenobarbital) môžu zvýšiť toxicitu paracetamolu tým, že pri jeho biotransformácii vzniká vyšší podiel toxického epoxidu. Absorpcia paracetamolu sa môže urýchliť podaním metoklopramidu. Prebenecid ovplyvňuje vylučovanie a plazmatickú koncentráciu paracetamolu.
4.6 Gravidita a laktácia
Tehotenstvo: Napriek tomu, že paracetamol prestupuje cez placentárnu bariéru, nepreukázali sa u novorodenca patologické zmeny. Paracetamol nie je vhodné podávať v 1. trimestri tehotenstva, v jeho ďalšom priebehu lekár musí starostlivo zvážiť priaznivý efekt lieku pre matku a potenciálne riziko pre plod.
Dojčenie: Aj keď sa paracetamol preukázal v mlieku dojčiacich žien, v moči dojčaťa nebol paracetamol ani jeho metabolity detegovaný, patologické zmeny u dojčaťa sa nezaznamenali.
Počas krátkodobej liečby nie je nutné dojčenie prerušiť, za predpokladu, že sa dojča starostlivo sleduje.
Fertilita: Štúdie chronickej toxicity paracetamolu u zvierat preukázali výskyt atrofie semenníkov a inhibíciu spermatogenézy, relevancia tohto nálezu u človeka však nie je známa.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pozornosť nie je ovplyvnená.
4.8 Nežiaduce účinky
Nežiaduce účinky paracetamolu sa v terapeutických dávkach vyskytujú len zriedkavo a s miernym klinickým priebehom. Raš, kožná alergia, len celkom ojedinele bronchospazmus. Len úplne zriedkavo sa vyskytujú poruchy krvotvorby - trombocytopénia, leukopénia, pancytopénia, neutropénia, agranulocytóza, hemolytická anémia a žltačka.
4.9 Predávkovanie
Príznaky predávkovania: Predávkovanie už relatívne nízkymi dávkami paracetamolu (8 – 15 g podľa telesnej hmotnosti pacienta) môže mať za následok závažné poškodenie pečene a niekedy akútnu renálnu tubulárnu nekrózu.
Do 24 hodín sa môže objaviť nauzea, vracanie, letargia a potenie. Bolesť v bruchu môže byť prvým príznakom poškodenia pečene a vzniká po 1 - 2 dňoch. Môže vzniknúť zlyhanie pečene, encefalopatia, kóma až smrť. Komplikáciu zlyhania pečene predstavuje acidóza, edém mozgu, krvácavé prejavy, hypoglykémia, hypotenzia, infekcia a renálne zlyhanie. Predĺženie protrombínového času je indikátorom zhoršenia funkcie pečene a preto sa odporúča jeho monitorovanie. Pacienti, ktorí užívajú induktory enzýmov (karbamazepín, fenytoín, barbituráty, rifampicín) alebo majú v anamnéze abúzus alkoholu, sú náchylnejší na poškodenie pečene. K akútnemu renálnemu zlyhaniu môže dôjsť aj bez prítomnosti závažného poškodenia pečene. Inými prejavmi intoxikácie sú poškodenie myokardu a pankreatitída.
Liečba predávkovania: Je nutná hospitalizácia. Pri nesprávnej aplikácii čapíkov p.o. sa odporúča vyvolanie vracania, výplach žalúdka, najmä ak sa paracetamol požil pred menej ako 4 hodinami, potom je nutné podať metionín (2,5 g p.o.), ďalej sú vhodné podporné opatrenia. Podanie aktívneho uhlia z dôvodov zníženia gastrointestinálnej absorpcie je sporné. Pri akomkoľvek mechanizmu predávkovania (p.o. alebo p.r.) sa odporúča monitorovanie plazmatickej koncentrácie paracetamolu. Špecifické antidotum acetylcysteín je nutné podať do 8 - 15 hodín po otrave, priaznivé účinky sa však pozorovali aj pri neskoršom podaní. Acetylcysteín sa väčšinou podáva dospelým a deťom i.v. v 5% glukóze v počiatočnej dávke 150 mg/kg telesnej hmotnosti počas 15 minút. Potom 50 mg/kg v infúzii 5% glukózy počas 4 hodín a ďalej 100 mg/kg do 16. resp. 20. hodiny od začiatku terapie. Acetylcysteín je možné podať aj p.o. do 10 hodín od požitia toxickej dávky paracetamolu v dávke 70 - 140 mg/kg 3 razy denne. Pri veľmi ťažkých otravách je možná hemodialýza či hemoperfúzia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
FARMAKOTERAPEUTICKÁ SKUPINA: Analgetikum, antipyretikum
ATC kód: N02BE01
Paracetamol je analgetikum - antipyretikum bez antiflogistickej aktivity a s dobrou gastrointestinálnou znášanlivosťou, vhodné v pediatrii aj u dospelých pacientov. Neovplyvňuje glykémiu a je teda vhodný aj u diabetikov. Pretože neovplyvňuje významne krvnú zrážavosť ani u pacientov užívajúcich perorálne antikoagulanciá, dá sa takisto použiť u hemofilikov. Nemá vplyv na hladinu kyseliny močovej a jej vylučovanie do moču. Je možné ho použiť všade tam, kde sú salicyláty kontraindikované.
Analgetický účinok paracetamolu po jednorazovej terapeutickej dávke 0,5 – 1 g trvá 3 – 6 hodín, antipyretický 3 – 4 hodiny. Intenzita obidvoch účinkov zodpovedá kyseline acetylsalicylovej v rovnakých dávkach.
5.2 Farmakokinetické vlastnosti
Paracetamol sa z rekta vstrebáva rýchlo a takmer úplne. Rýchlo sa distribuuje do všetkých tkanív a telesných tekutín. Prechádza cez hematoencefalickú bariéru, do slín a do materského mlieka. Intenzívne sa biotransformuje, popri konjugačných reakciách dochádza k oxidatívnym pochodom, pričom vznikajú toxické metabolity. Pri podaní terapeutických dávok dochádza k rýchlej biotransformácii týchto hepatotoxických intermediálnych metabolitov za spolupôsobenia glutationu a vzniku merkapturových kyselín, ktoré sa vylučujú močom prevažne vo forme konjugátov, menej ako 5% paracetamolu sa vylúči v nezmenenej forme. Biologický polčas sa pohybuje medzi 1 - 3 hodinami, pri závažnej pečeňovej insuficiencii sa predlžuje až na 5 hodín. Pri insuficiencii obličiek nedochádza k jeho predĺženiu, ale pretože sa vylučuje najmä obličkami, je nutné dávku paracetamolu redukovať. Paracetamol prestupuje cez placentárnu bariéru a vylučuje sa do materského mlieka.
5.3 Predklinické údaje o bezpečnosti
LD50u myši: (mg/kg) p.o. 338, i.p. 500.
6. FARMACEUTICKÉ ÚDAJE
6.1 Zoznam pomocných látok
Adeps pro suppositorio W 35, Adeps pro suppositorio H 15
6.2 Inkompatibility
Nie sú známe
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
V suchu, pri teplote 10 – 25 C.
Uchovávajte mimo dosahu a dohľadu detí!
6.5 Druh obalu a obsah balenia
Al strip, papierová škatuľka, písomná informácia pre používateľov.
Balenie: 5 čapíkov
6.6 Špeciálne opatrenia na likvidáciu
Žiadne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Zentiva k.s., Praha, Česká republika
8. REGISTRAČNÉ ČÍSLO
07/0185/81-C/S
9. DÁTUM REGISTRÁCIE/DÁTUM PREDĹŽENIA REGISTRÁCIE
10.11.1981
10. DÁTUM POSLEDNEJ REVÍZIE TEXTU
Jún 2009