Žiadne produkty
Ceny sú s DPH
Kategórie
- Ponuka práce: FARMACEUT - LEKÁRNIK
- K O R O N A V Í R U S - COVID-19
- Plus lekáreň
- Ambulancia lekára
- Bandáže, návleky, pásy
- Barle, palice, chodítka
- Bylinné prípravky
- Dezinfekcia
- Diagnostické testy
- Elektro
- Glukometer
- Iné pomôcky pre pacientov
- Inhalátory
- Inkontinencia - únik moču
- Invalidita
- Kompresívna liečba
-
Kozmetika - Drogéria
- Telová kozmetika
- Vlasová kozmetika
- Pleťová kozmetika
- Prípravky na holenie a depiláciu
- Intímna hygiena
- Pranie
- Domácnosť
-
Značky
- Himalaya
- Adidas
- Airwick
- Ajax
- Alex
- Always
- Ambipur
- Ariel
- Aussie
- Axe
- Batiste
- Bel
- Bonux
- Bref
- Bubchen
- Calgon
- Cif
- Cilit Bang
- Clin
- Coccolino
- Denim
- Dettol
- Discreet
- Domestos
- Dove
- Duck
- Durex
- Elseve
- Eos
- Fa
- Finish
- Fixinela
- Garnier
- Gillette
- Glade
- Got2be
- Head & Shoulders
- Jar
- Johnsons
- Kallos
- Kleenex
- Kneipp
- Ko+ex
- Lanza
- Lenor
- Loreal
- Mexx
- Mr. Proper
- Naturella
- Neutrogena
- Nivea
- Nova Car Care
- o.b.
- Old Spice
- Oral -B
- Palette
- Palmolive
- Pampers
- Pantene
- Persil
- Perwoll
- Playboy
- Pronto
- Puella
- Pur
- Raid
- Rex
- Rexona
- Ria
- Sanytol
- Savo
- Schauma
- Scholl
- Signal
- Silan
- Somat
- STR8
- Syoss
- Taft
- Tesori d-oriente
- TRESemmé
- Vanish
- Veet
- Wella
- Wilkinson
- Woolite
- Zewa
- Starostlivosť o vlasy
- Lekárničky, náplne
- Liečba svetlom
- Masážne prípravky
- Mikroskopy
- Opaľovanie
- Optické prístroje špeciálne
- Pečené čaje z ovocia
- Potravinové doplnky
- Pre dámy
- Pre deti
- Pre pánov
- Preležaniny a ošetrovanie
- Repelenty
- Starostlivosť o nechty
- Starostlivosť o nohy
- STÓMIA a stomické pomôcky
- Teplomery
- Tlakomery
- Veterinárne liečivá
-
Voľnopredajné lieky
- Alergia
- Antikoncepcia
- Bolesť hlavy
- Bolesť hrdla
- Bolesť svalov a kĺbov
- Bolesti zubov
- Chrípka a prechladnutie
- Dezinfekcia kože
- Fytofarmaká
- Homeopatiká
- Horúčka
- Horúčka u detí
- Imunitný systém
- Intímna hygiena
- Kašeľ
- Kožné choroby
- Kŕčové žily
- Krv, srdce a obehový systém
- Menštruačné bolesti
- Na chudnutie
- Poruchy trávenia
- Spánok
- Stop fajčeniu
- Upchatý nos
- Vlasy, nechty pokožka
- Výživové doplnky
- Urologické problémy
- Zmyslové orgány
- Pamäť a normálná funkciá nervovej sústavy
-
Voľnopredajné lieky podľa skupín
- 69 - Otorinolaringologiká
- 24 - Antihistaminiká, histamín
- 46 - Dermatologiká
- 17 - Antikoncepčné prípravky
- 07 - Analgetiká, antipyretiká
- 29 - Antireumatiká, antiflogistiká, antiuratiká
- 86 - Vitamíny, vitagény
- 52 - Expektoranciá, mukolytiká
- 93 - Homeopatiká
- 94 - Fytofarmaká
- 15 - Antibiotiká (proti mikróbom a vírusovým infekciám)
- 39 - Soli a ióny pre perorálnu a perenterálnu aplikáciu
- 70 - Anxiolytiká
- 85 - Venofarmaká, vazoprotektíva
- 87 - Varia I
- 95 - Stomatologiká III
- 49 - Digestíva, adsorbenciá, acidá
- 32 - Antiseptiká, dezinficienciá (lokálne)
- 92 - Tradičný rastlinný liek
- 91 - Multivitamíny a stopové prvky
- 54 - Gynekologiká
- 36 - Antitusiká
- 26 - Antimykotiká (lokálne a celkové)
- 42 - Chemoterapeutiká (vrátane tuberkulostatík)
- 23 - Antihemoroidiká
- 16 - Antikoagulanciá (fibrinolytiká, antifibrinolytiká)
- 41 - Kardiaká
- 12 - Antianemiká
- 61 - Laxatíva
- 43 - Choleretiká, cholekinetiká
- 09 - Antacidá (vrátane antiulceróznych liečiv)
- 20 - Antiemetiká, antikinetiká
- 73 - Spazmolytiká
- Výživové nápoje
- Zdravé zuby
- Všeobecná ambulancia pre dospelých, körzeti orvosi rendelö MUDr. Rudolf Pelikán
- Zdravotná obuv ktorá pomáha
- Gynekologicko - pôrodnícka ambulancia
- NANO produkty
- Naši partneri
- Záhrada
- Lekáreň TABLETKA - výučbová lekáreň
- Akreditovaný rozbor vody - Danum,s.r.o
- BEZ KONZERVANTOV DOMÁCE PRODUKTY
- Novinky
- Akcie a zľavy
Navštívené produkty
-
Ambrosan 30 mg tbl...
Ambrosan® sa používa na liečbu...
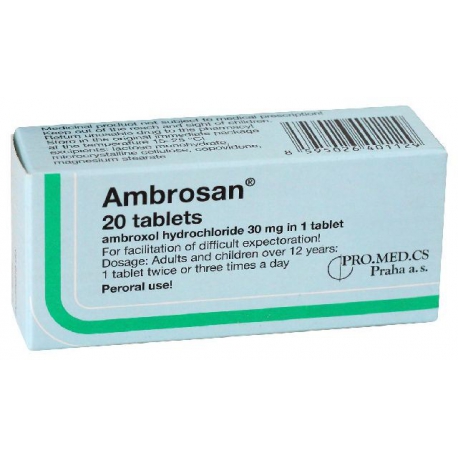
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
1. NÁZOV LIEKU
Ambrosan 30 mg
-
KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Liečivo: Ambroxoli hydrochloridum 30 mg v 1 tablete.
Pomocné látky: pozri časť 6.1.
3. LIEKOVÁ FORMA
Tablety
Vzhľad lieku:takmer biele hladké ploché tablety s poliacou ryhou na jednej strane a so skosenými hranami.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Mukolytická liečba akútnych a chronických bronchopulmonálnych ochorení, ktoré sú spojené s abnormálnou sekréciou hlienu a poruchou jeho transportu (zápaly horných a dolných dýchacích ciest, infekčné ochorenia dýchacích ciest), zápalové rhinofaryngeálne ochorenia.
4.2 Dávkovanie a spôsob podávania
Dospelí a deti od 12 rokov: 1 tableta 3-krát denne.
Liečebný účinok môže byť zvýšený podaním 2 tabliet 2-krát denne.
Deti 5 – 12 ročné: ½ tablety 2 až 3-krát denne.
Tablety sa majú užívať po jedle a dostatočne zapiť. Prívod tekutín zvyšuje mukolytický účinok ambroxolu.
Dĺžka liečby Ambrosanom 30 mg je určená individuálne, v závislosti na indikácii a typu ochorenia.
-
Kontraindikácie
-
Ambrosan 30 mg sa nesmie podávať pacientom so známou precitlivenosťou na ambroxol alebo na ktorúkoľvek z pomocných látok obsiahnutých v lieku.
4.4 Osobitné upozornenia a opatrenia pri používaní
Zvýšená pozornosť je potrebná u pacientov s vredovou chorobou žalúdka alebo duodena.
Liek obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózogalaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Podávanie ambroxolu spoločne s antibiotikami (amoxicilín, cefuroxim, erytromycín, doxycyklín) vedie k zvýšeniu koncentrácie antibiotík v pľúcnom tkanive. Tento efekt je možné terapeuticky využiť. Kombinácia s antitusikami môže spôsobiť nebezpečné hromadenie sekrétu, spôsobené znížením vykašliavacieho reflexu.
4.6 Fertlita, gravidita a laktácia
Predklinické štúdie, rovnako ako rozsiahle klinické skúsenosti po 28. týždni gravidity, neodhalili žiadny dôkaz negatívnych účinkov pri podávaní počas gravidity. Napriek tomu sa majú dodržovať všeobecné zásady užívania liekov počas gravidity, zvlášť v 1. trimestri. Ambroxol prechádza do materského mlieka, ale pri podávaní terapeutických dávok nie je pravdepodobné ohrozenie dojčaťa. Pri prípadnom užití v období gravidity alebo laktácie je vždy potrebné starostlivo zvážiť pomer rizika k prínosu liečby.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neboli uskutočnené štúdie hodnotiace ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje.
-
Nežiaduce účinky
-
Ambrosan 30 mg sa obvykle dobre znáša.
Menej časté (>1/1000, <1/10): gastrointestinálne ťažkosti (napr. pálenie záhy, nechutenstvo, pocit na vracanie, vracanie).
Zriedkavé (>1/10 000 < 1/1000): alergické reakcie, najmä kožné vyrážky.
Veľmi zriedkavé (<1/10 000): prípady závažných reakcií anafylaktického typu, avšak ich príčinná súvislosť s podávaním ambroxolu nebola úplne preukázaná.
4.9 Predávkovanie
Do súčasnej doby neboli zaznamenané žiadne prejavy predávkovania ľudí.
Pokiaľ sa vyskytnú príznaky predávkovania, má sa zahájiť symptomatická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Expektoranciá, mukolytiká.
ATC kód: R05CB06
V predklinických štúdiách bolo zistené, že ambroxol, liečivo v Ambrosane 30 mg, zvyšuje sekréciu hlienu v respiračnom trakte. Zvyšuje tvorbu pľúcneho surfaktantu a stimuluje činnosť riasiniek Toto pôsobenie vedie k zlepšeniu transportu sliznicou (mukociliárny klírens). Zvýšenie hlienovej sekrécie a mukociliárny klírens uľahčuje vykašliavanie a zmierňuje kašeľ. Ambroxol znižuje bronchiálnu hyperreaktivitu, zvyšuje sekréciu IgA do bronchiálneho sekrétu a vykazuje antioxidačné účinky.
5.2 Farmakokinetické vlastnosti
Absorpcia všetkých perorálnych foriem ambroxolu so spomaleným účinkom je rýchla a takmer úplná a v terapeutickom rozmedzí dávkovanie vykazuje lineárnu závislosť na dávke. Maximálne plazmatické hladiny sa dosahujú v priebehu 0,5 až 3 hodín.
Pri dávkovaní v terapeutickom rozmedzí je väzba na plazmatické proteíny približne 90 %. Voľná frakcia ambroxolu je relatívne dobre distribuovaná z krvi do tkanív, najvyššia koncentrácia sa dosahuje v pľúcnom tkanive.
Plazmatický polčas je 7 až 12 hodín, kumulácia nebola zaznamenaná.
Približne 30 % perorálne podanej dávky je eliminované v prvej fázi. Ambroxol je metabolizovaný hlavne konjugáciou v pečeni. Asi 90 % dávky sa eliminuje renálnou cestou.
5.3 Predklinické údaje o bezpečnosti
Perorálne dávky 150 mg/kg (myš), 50 mg/kg (potkan), 40 mg/kg (králik) a 50 mg/kg (pes) predstavujú dávky, ktoré v opakovaných štúdiách v trvaní až 6 mesiacov nevykazujú žiadne nežiaduce účinky. Z toxikologického hľadiska nebol pre ambroxol zistený žiaden cieľový orgán. Neboli zistené žiadne embryotoxické alebo teratogénne účinky pri perorálnych dávkach až 3 000 mg/kg u potkanov a 200 mg/kg u králikov. Fertilita samcov a samíc potkana nebola poškodená až do dávky 500 mg/kg. Tzv. hladina "žiadnych nežiaducich účinkov" bola pri perinatálnom a postnatálnom podávaní stanovená na 50 mg/kg. Dávka 500 mg/kg bola mierne toxická pre feny a šteňatá, čo sa prejavilo spomalením hmotnostných prírastkov a znížením počtu mláďat vo vrhu.
Ambroxol nebol mutagénny (Amesov test a mikronukleárny test).
Liečivo v lieku nevykazovalo tumorogénne vlastnosti v štúdiách karcinogenity na myšiach a potkanoch.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Monohydrát laktózy, granulovaná mikrokryštalická celulóza, kopovidón, magnéziumstearát.
6.2 Inkompatibility
Neaplikovateľné
6.3 Čas použiteľnosti
2 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v suchu, pri teplote neprevyšujúcej 25°C, chráňte pred svetlom.
-
Druh obalu a obsah balenia
-
PVC/Al blister, papierová škatuľka, písomná informácia pre používateľov.
Veľkosť balenia: 20, 30, 60, 100 a 500 tabliet.
Nie všetky veľkosti balenia musia byt' uvedené na trh.
-
Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
-
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
PRO.MED.CS Praha a.s., Telčská 1, 140 00 Praha 4, Česká republika.
8. REGISTRAČNÉ ČÍSLO
52/0788/92 – C/S
9. DÁTUM REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
02.12.1992
10. DÁTUM REVÍZIE TEXTU
Október 2011