Žiadne produkty
Ceny sú s DPH
Kategórie
- Ponuka práce: FARMACEUT - LEKÁRNIK
- K O R O N A V Í R U S - COVID-19
- Plus lekáreň
- Ambulancia lekára
- Bandáže, návleky, pásy
- Barle, palice, chodítka
- Bylinné prípravky
- Dezinfekcia
- Diagnostické testy
- Elektro
- Glukometer
- Iné pomôcky pre pacientov
- Inhalátory
- Inkontinencia - únik moču
- Invalidita
- Kompresívna liečba
-
Kozmetika - Drogéria
- Telová kozmetika
- Vlasová kozmetika
- Pleťová kozmetika
- Prípravky na holenie a depiláciu
- Intímna hygiena
- Pranie
- Domácnosť
-
Značky
- Himalaya
- Adidas
- Airwick
- Ajax
- Alex
- Always
- Ambipur
- Ariel
- Aussie
- Axe
- Batiste
- Bel
- Bonux
- Bref
- Bubchen
- Calgon
- Cif
- Cilit Bang
- Clin
- Coccolino
- Denim
- Dettol
- Discreet
- Domestos
- Dove
- Duck
- Durex
- Elseve
- Eos
- Fa
- Finish
- Fixinela
- Garnier
- Gillette
- Glade
- Got2be
- Head & Shoulders
- Jar
- Johnsons
- Kallos
- Kleenex
- Kneipp
- Ko+ex
- Lanza
- Lenor
- Loreal
- Mexx
- Mr. Proper
- Naturella
- Neutrogena
- Nivea
- Nova Car Care
- o.b.
- Old Spice
- Oral -B
- Palette
- Palmolive
- Pampers
- Pantene
- Persil
- Perwoll
- Playboy
- Pronto
- Puella
- Pur
- Raid
- Rex
- Rexona
- Ria
- Sanytol
- Savo
- Schauma
- Scholl
- Signal
- Silan
- Somat
- STR8
- Syoss
- Taft
- Tesori d-oriente
- TRESemmé
- Vanish
- Veet
- Wella
- Wilkinson
- Woolite
- Zewa
- Starostlivosť o vlasy
- Lekárničky, náplne
- Liečba svetlom
- Masážne prípravky
- Mikroskopy
- Opaľovanie
- Optické prístroje špeciálne
- Pečené čaje z ovocia
- Potravinové doplnky
- Pre dámy
- Pre deti
- Pre pánov
- Preležaniny a ošetrovanie
- Repelenty
- Starostlivosť o nechty
- Starostlivosť o nohy
- STÓMIA a stomické pomôcky
- Teplomery
- Tlakomery
- Veterinárne liečivá
-
Voľnopredajné lieky
- Alergia
- Antikoncepcia
- Bolesť hlavy
- Bolesť hrdla
- Bolesť svalov a kĺbov
- Bolesti zubov
- Chrípka a prechladnutie
- Dezinfekcia kože
- Fytofarmaká
- Homeopatiká
- Horúčka
- Horúčka u detí
- Imunitný systém
- Intímna hygiena
- Kašeľ
- Kožné choroby
- Kŕčové žily
- Krv, srdce a obehový systém
- Menštruačné bolesti
- Na chudnutie
- Poruchy trávenia
- Spánok
- Stop fajčeniu
- Upchatý nos
- Vlasy, nechty pokožka
- Výživové doplnky
- Urologické problémy
- Zmyslové orgány
- Pamäť a normálná funkciá nervovej sústavy
-
Voľnopredajné lieky podľa skupín
- 69 - Otorinolaringologiká
- 24 - Antihistaminiká, histamín
- 46 - Dermatologiká
- 17 - Antikoncepčné prípravky
- 07 - Analgetiká, antipyretiká
- 29 - Antireumatiká, antiflogistiká, antiuratiká
- 86 - Vitamíny, vitagény
- 52 - Expektoranciá, mukolytiká
- 93 - Homeopatiká
- 94 - Fytofarmaká
- 15 - Antibiotiká (proti mikróbom a vírusovým infekciám)
- 39 - Soli a ióny pre perorálnu a perenterálnu aplikáciu
- 70 - Anxiolytiká
- 85 - Venofarmaká, vazoprotektíva
- 87 - Varia I
- 95 - Stomatologiká III
- 49 - Digestíva, adsorbenciá, acidá
- 32 - Antiseptiká, dezinficienciá (lokálne)
- 92 - Tradičný rastlinný liek
- 91 - Multivitamíny a stopové prvky
- 54 - Gynekologiká
- 36 - Antitusiká
- 26 - Antimykotiká (lokálne a celkové)
- 42 - Chemoterapeutiká (vrátane tuberkulostatík)
- 23 - Antihemoroidiká
- 16 - Antikoagulanciá (fibrinolytiká, antifibrinolytiká)
- 41 - Kardiaká
- 12 - Antianemiká
- 61 - Laxatíva
- 43 - Choleretiká, cholekinetiká
- 09 - Antacidá (vrátane antiulceróznych liečiv)
- 20 - Antiemetiká, antikinetiká
- 73 - Spazmolytiká
- Výživové nápoje
- Zdravé zuby
- Všeobecná ambulancia pre dospelých, körzeti orvosi rendelö MUDr. Rudolf Pelikán
- Zdravotná obuv ktorá pomáha
- Gynekologicko - pôrodnícka ambulancia
- NANO produkty
- Naši partneri
- Záhrada
- Lekáreň TABLETKA - výučbová lekáreň
- Akreditovaný rozbor vody - Danum,s.r.o
- BEZ KONZERVANTOV DOMÁCE PRODUKTY
- Novinky
- Akcie a zľavy
Navštívené produkty
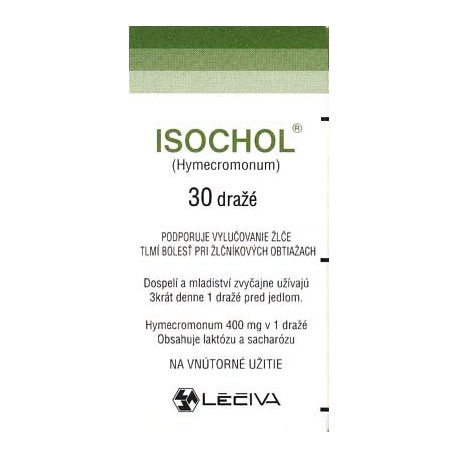
ISOCHOL tbl obd 30x400 mg (fľ. skl. hnedá)
93157
- Napíšte názor
SÚHRN CHARAKTERISTICKÝCH VLASTNOSTÍ LIEKU
1. NÁZOV LIEKU
ISOCHOL
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Hymecromonum (hymekromón) 400 mg v 1 obalenej tablete.
Pomocné látky so známym účinkom: laktóza, sacharóza
Úplný zoznam pomocných látok: pozri časť 6.1
3. LIEKOVÁ FORMA
Obalená tableta
Biele obalené tablety
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Terapeutické použitie: Spazmy v oblasti žlčníka, žlčových ciest a Oddiho zvierača (biliárne koliky, dyskinézy žlčových ciest), na uľahčenie odchodu reziduálnych konkrementov zo žlčových ciest po endoskopickej papilotómii alebo po operáciách na žlčových cestách, na urýchlenie normalizácie pooperačnej hyperbilirubinémie, na odstránenie spazmov v oblasti Vaterskej papily po mechanickej iritácii (kanylácia pri ERCP, biopsii, intraoperačná sondáž), chronická cholecystitída, cholelitiáza, dyspeptické ťažkosti pri chronických hepatopatiách, biliárna dyspepsia, syndróm cholestázy, postcholecystektomický syndróm, chronická obstipácia, niektoré formy migrény (pri súčasnej cholecystolitiáze).
Diagnostické použitie: Pri ERCP na uľahčenie kanylácie Vaterskej papily (nemôže však nahradiť nedokonalú endoskopickú techniku sondáže), na odlíšenie funkčných spazmov od organických stenóz Vaterskej papily (pri organickej stenóze sa ťažkosti zhoršia vplyvom zvýšenej cholerézy proti prekážke, ktorú hymekromón neuvoľní).
4.2 Dávkovanie a spôsob podávania
Zvyčajná dávka pre dospelých a mladistvých je pre všetky indikácie 3 razy denne 1 obalená tableta. Pri hnačke dávku znížiť. Obalené tablety sa užívajú dlhodobo počas niekoľkých týždňov alebo mesiacov alebo iba krátkodobo v období ťažkostí. Tiež sa môže užiť 1 obalená tableta preventívne pred očakávanou väčšou digestívnou záťažou. Obalené tablety sa užívajú pred jedlom, prehĺtajú sa celé, nerozhryznuté s malým množstvom tekutiny.
4.3 Kontraindikácie
-
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1;
-
Akútne zápaly žlčových ciest, obštrukcie žlčových ciest;
-
Ťažká pečeňová insuficiencia;
-
M. Crohnova, idiopatická proktokolitída;
-
Ťažká porucha renálnych funkcií.
Liek nie je vhodný pre deti mladšie ako 14 rokov.
4.4 Osobitné upozornenia a opatrenia pri používaní
Isochol obsahuje sacharózu a laktózu.
Pacienti so zriedkavými dedičnými poruchami: intoleranciou fruktózy a galaktózy, glukózo-galaktózovej malabsorpcie alebo deficitom sacharózy, laktázy a izomaltázy nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Klinicky významné interakcie nie sú známe.
4.6 Fertilita, gravidita a laktácia
Nepreukázala sa bezpečnosť pri podaní počas gravidity. Liek sa môže podať len krátkodobo pri akútnych ťažkostiach, je nutné zvážiť priaznivý liečebný efekt a potenciálne riziko pre plod.
Nie sú známe údaje o prestupe do materského mlieka, laktácia sa počas terapie neodporúča.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Isochol nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
V nasledujúcej tabuľke sú zhrnuté nežiaduce účinky hymekromónu rozdelené do skupín podľa terminológie MedDRA s uvedením frekvencie výskytu: Veľmi časté (1/10), Časté (1/100 až <1/10), Menej časté (1/1 000 až <1/100), Zriedkavé (1/10 000 až <1/1 000), Veľmi zriedkavé (<1/10 000), neznáme (častosť sa nedá odhadnúť z dostupných údajov)>
|
Trieda orgánových systémov podľa databázy MedDRA |
Frekvencia |
Nežiaduci účinok |
|
Poruchy nervového systému |
zriedkavé |
bolesť hlavy |
|
Poruchy gastrointestinálneho traktu |
neznáme |
hnačka* |
|
Poruchy kože a podkožného tkaniva |
zriedkavé |
exantém |
* mierny laxatívny efekt zvyčajne neprekáža liečbe
Zvýraznenie ťažkostí (tlak až bolesť v pravom podrebrí) signalizuje možnosť organickej prekážky v žlčových cestách (stenóza Vaterskej papily), liek je potom nutné vysadiť.
4.9 Predávkovanie
Predávkovanie: hymekromón nie je toxický, pri požití väčších dávok sa objavia hnačky.
Terapia je symptomatická, výplach žalúdka, podanie aktívneho uhlia, prípadne korekcia vodného a elektrolytového hospodárenia (vznik acidózy, straty kália).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Liečivá žlčových ciest a pečene
ATC kód:A05AX02
Hymekromón, metylkumarínový derivát je muskulotropné spazmolytikum selektívne pôsobiace na žlčník, žlčové cesty a Oddiho zvierač, nemá parasympatolytické účinky. Pôsobí tiež ako pravé choleretikum, zvyšuje vylučovanie žlče a žlčových solí, priaznivo ovplyvňuje litogénny index žlče, ovplyvňuje regeneráciu hepatocytov poškodených cholestázou.
5.2 Farmakokinetické vlastnosti
Hymekromón sa veľmi dobre vstrebáva po perorálnom podaní, maximálne hladiny v plazme (po 400 mg okolo 5 g/ml) dosahuje medzi 2. - 3. hodinou po podaní, biologický polčas kolíše medzi 2,5 - 5 hodinami. Po podaní hymekromónu dochádza k rýchlej konjugácii, takže sa v krvi nachádza prevažne ako glukoziduronát, podlieha enterohepatálnemu cyklu, vylučuje sa prevažne močom. Pri poškodení pečeňového parenchýmu sa predlžuje biologický polčas až dvojnásobne.
5.3 Predklinické údaje o bezpečnosti
Akútna toxicita
Zisťovala sa u myší a potkanov je veľmi nízka a nie je možné ju z technických dôvodov stanoviť po p.o. podaní.
LD50 v mg/kg telesnej hmotnosti:
myš, potkan : p.o. 7593 6220
i.v. 250
i.p. 325 - 750
Chronická toxicita
Zisťovaná u potkanov a psov. Pri p. o. podaní v dávke 400 až 1000 mg/kg telesnej hmotnosti a deň, príp. 800 až 2 400 mg/kg telesnej hmotnosti a deň počas 2 - 4 mesiacov sa hymekromón dobre znášal, nepozorovali sa zmeny v správaní, chuti do jedla a telesnej hmotnosti. Takisto sa nenašli zmeny v krvnom obraze, laboratórne odchýlky, makroskopické či histologické orgánové zmeny.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Monohydrát laktózy, kukuričný škrob, želatína, sodná soľ karboxymetylškrobu, mastenec, kalciumstearát vápenatý, sacharóza, sodná soľ karmelózy, oxid titaničitý (E 171), zmes bieleho a karnaubského vosku
6.2 Inkompatibility
Nie sú známe.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 C. Fľašku udržiavajte dôkladne uzatvorenú na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
Druh obalu: sklenená fľaška s uzáverom a poistnou vložkou, papierová škatuľka.
Veľkosť balenia: 30 obalených tabliet
6.6Špeciálne opatrenia na likvidáciua iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Zentiva, k.s., Praha, Česká republika
8. REGISTRAČNÉ ČÍSLO
43/0172/87-CS
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 1987
Dátum posledného predĺženia: 17.02.2005/bez časového obmedzenia
10. DÁTUM REVÍZIE TEXTU
November 2012